[OCT Observations] Imagerie multimodale de la sécheresse oculaire par OCT
La sécheresse oculaire est une pathologie multifactorielle qui affecte les larmes et la surface oculaire et qui peut entraîner des lésions de l’épithélium conjonctival et cornéen.
Les progrès de l’imagerie par OCT spectral domain ont permis de mieux individualiser les différentes couches cornéennes avec la possibilité de réaliser des cartographies de l’épithélium cornéen dont la mesure inclut le film lacrymal offrant ainsi une projection de l’état de la surface oculaire.
![[OCT Observations] Imagerie multimodale de la sécheresse oculaire par OCT Image](https://blog.visionix.com/hs-fs/hubfs/eye-5248678_1280.jpg?width=1250&name=eye-5248678_1280.jpg)
Imagerie multimodale de la sécheresse oculaire par OCT
Le remodelage de l’épithélium cornéen ainsi que sa capacité compensatrice pour maintenir un équilibre biomécanique de la cornée sont connus et son rôle est important pour le maintien d’une qualité optique élevée. Une régénération continue des cellules épithéliales est fondamentale pour garantir leurs fonctions, et plusieurs facteurs tels que le film lacrymal, l’innervation neuronale, le clignement réflexe contribuent à maintenir un environnement favorable au renouvellement de l’épithélium cornéen.
La morphologie de l’épithélium cornéen au cours des différents stades de la sécheresse oculaire présente des caractéristiques variables, associées à d’autres critères d’analyse disponibles sur nos appareils tels que l’évaluation du ménisque de larmes, la meibographie, et qui offrent ainsi une approche multimodale par OCT de la surface oculaire.
Topographie de l’épithélium cornéen normal en OCT
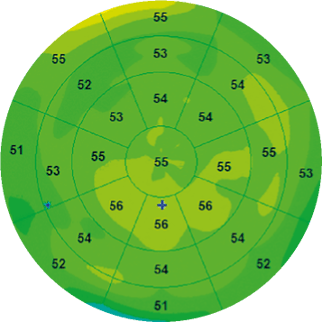 |
D.Z. Reinstein et al. ont été les premiers à analyser l’épithélium cornéen en réalisant des cartographies de toute la surface cornéenne grâce à un appareillage d’échographie de très haute fréquence, l’Artémis [1]. D’après leur étude, l’épaisseur épithéliale moyenne d’un sujet normal, excluant l’épaisseur du film lacrymal d’environ 4,79 ± 0,88 µm, était de 53,4 ± 4,6 µm. Leurs travaux ont démontré que l’épithélium cornéen est plus épais dans sa partie inférieure que dans sa partie supérieure dans les cornées normales probablement en raison du frottement résultant de la dynamique du clignement des paupières (figure 1). En effet, le mouvement plus ample de la paupière supérieure crée davantage de frottements sur la surface oculaire et exerce un effet mécanique sur les cellules épithéliales en induisant un amincissement de l’épithélium. |
Figure 1. Carte épithéliale d’un œil normal avec une distribution uniforme. |
Les récentes évolutions de l’OCT, notamment en matière de résolution axiale, nous permettent, grâce à des outils de segmentation, d’isoler la couche de l’épithélium cornéen en détectant automatiquement le film lacrymal et l’interface épithélium-couche de Bowman. Le logiciel permet ensuite de générer une topographie de l’épithélium cornéen de 6 × 6 mm, de 9 × 9 mm et même désormais de 10 × 10 mm offrant ainsi une meilleure corrélation avec la topographie cornéenne (figure 1). L’un des appareillages les plus performants est actuellement le SOLIX™ (Visionix, Fremont, États-Unis) avec lequel nous avons réalisé ce travail.
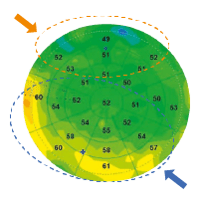
En OCT, la mesure non invasive de l’épithélium cornéen inclut le film lacrymal, et l’épaisseur moyenne selon Y. Li et al. [2] serait chez un sujet normal de 52,3 ± 3,6 µm au centre, de 49,6 ± 3,5 µm en supérieur et de 51,2 ± 3,4 µm en inférieur, ce qui corrobore les travaux menés avec l’Artémis (figure 2).
|
|
|
| 6mm epithelial map XR Avanti™, Optovue | 9mm epithelial map XR Avanti™, Optovue | 10mm epithelial map Solix™, Optovue |
Figure 2. Cartographies épithéliales de différents diamètres d’un même patient soulignant l’intérêt clinique contributif d’une -cartographie plus large. Dans ce cas précis, l’hyperplasie de l’épithélium cornéen est mieux visualisée en 10 mm avec un début d’amincissement de -l’épithélium cornéen en supérieur.
Une étude, menée par A.J. Kanellopoulos et G. Asimellis [3], a montré une certaine précision des mesures OCT de l’épithélium cornéen avec une répétabilité des mesures de 1 µm et une variabilité de l’épaisseur topographique de l’ordre de 0,25 µm. Cette précision est importante à rappeler quand on connaît les faibles variations, de quelques microns, des modifications de l’épithélium cornéen.
Remodelage épithélial et sécheresse oculaire
La mesure de l’épithélium cornéen en OCT offre une projection de l’état de la surface oculaire non seulement car elle inclut le film lacrymal [4], mais aussi car la pachymétrie épithéliale varie en fonction de l’état de la surface oculaire. Le remodelage de l’épithélium cornéen ainsi que sa capacité compensatrice pour maintenir un équilibre biomécanique de la cornée sont connus, et son rôle est important pour le maintien d’une qualité optique élevée.
Dans la sécheresse oculaire au stade débutant, la pachymétrie épithéliale met en évidence une hyperplasie de l’épithélium cornéen avec une prédominance de l’apex cornéen en inférieur. Le niveau d’hyperplasie semble également étroitement lié au niveau de dysfonctionnement meibomien, et il est ainsi fréquent de retrouver une hyperplasie plus prononcée sur l’œil présentant un dysfonctionnement meibomien de stade plus avancé (figure 3).
La zone hyperplasique de l’épithélium correspond souvent à la localisation cornéenne où sont observés les premiers signes de rupture du film lacrymal lors de l’examen du break-up time (figure 4).
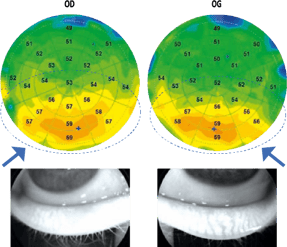
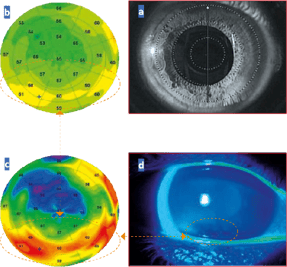
Figure 3 (L). Patiente, âgée de 27 ans, avec un tableau de blépharite d’origine accommodative qui présente une hyperplasie épithéliale bilatérale en inférieur de l’apex, d’aspect plus prononcé de l’œil droit où la meibographie montre un dysfonctionnement des glandes de Meibomius plus accentué.
Figure 4 (R) a.Image de la cornée du patient avec caméra infrarouge de l’OCT lors de l’acquisition des images.
b. Topographie pachy-métrique épithéliale révélant une hyperplasie en forme de croissant en inférieur de l’apex.
c. Topographie pachymétrique épithéliale avec échelle normalisée soulignant de manière plus évidente cette hyperplasie.
d. Corrélation de l’examen du break-up time montrant une rupture du film lacrymal associée à quelques traces de kératite ponctuée superficielle correspondant exactement à la zone d’hyperplasie de l’épithélium cornéen.
Cette hyperplasie peut être retrouvée dans d’autres localisations cornéennes en fonction de la chronicité de la sécheresse oculaire (figure 5).
Des études en immunofluorescence sur des modèles de souris ayant une sécheresse oculaire induite dans une chambre à environnement contrôlé ont démontré, grâce à la mise en évidence de la protéine Ki-67 (marqueur de prolifération cellulaire), une hyperplasie des cellules épithéliales cornéennes [5]. Cette hyperplasie épithéliale semble d’origine réactionnelle et liée aux microlésions induites que ce soit en raison d’un stress hyperosmolaire ou de l’effet microabrasif du clignement pour le maintien de la surface oculaire dans les atteintes de sécheresse modérées. Les mécanismes ne sont pas encore complètement élucidés, mais l’hypothèse la plus vraisemblable serait que la sécheresse oculaire pourrait être à l’origine d’une inflammation neurogène ou non et que l’augmentation de cytokines pro-inflammatoires serait impliquée dans la prolifération cellulaire et la kératinisation [6, 7].
Après un traitement associant hygiène des paupières avec masque chauffant et agent mouillant en 1re intention, on observe une résorption quasi complète de l’aspect d’hyperplasie épithéliale par normalisation de la surface oculaire après amélioration de la blépharite (figure 6, p. 72). La régression de l’hyperplasie épithéliale met en évidence que ces modifications sont bien en rapport avec des troubles de la surface oculaire, ce qui explique également l’impact des troubles de la surface oculaire sur la kératométrie, la réfraction de nos patients, donc leur instabilité visuelle. D’autre part, cette corrélation entre les zones d’hyperplasie de l’épithélium cornéen et la zone des premiers signes de rupture du film lacrymal suggère un mécanisme d’autorégulation entre l’épithélium cornéen et le film lacrymal pour garantir une certaine qualité optique.
L’hyperplasie de l’épithélium cornéen observée sur les topographies épithéliales en OCT dans la sécheresse oculaire pourrait être compensatoire au début de la maladie ; ensuite, une dégradation trophique s’installerait au cours de la phase chronique de la maladie, comme en témoignent les amincissements épithéliaux observés. En effet, par la suite une diminution des larmes va induire une augmentation de la fréquence de clignement et conduire à un frottement mécanique plus accru et ainsi à un amincissement plus marqué en supérieur de l’apex.
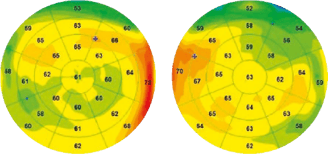
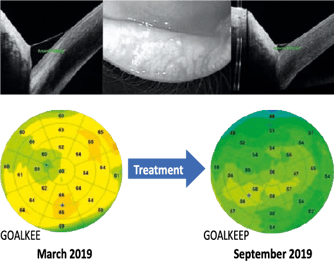
Figure 5 (L). Hyperplasie épithéliale réactionnelle dont la localisation est plus irrégulière avec une surface plus étendue dans un contexte de blépharite chronique d’origine accommodative chez une patiente âgée de 50 ans ne portant pas sa correction optique.
Figure 6 (R). Suivi d’un patient, âgé de 45 ans, atteint d’une blépharite associée à une hyperplasie réactionnelle de l’épithélium cornéen et à un certain volume de ménisque lacrymal basal objectivé par une image en coupe en OCT. Après 6 mois de traitement, on observe une quasi-normalisation de la carte épithéliale et une réduction du volume du ménisque de larmes avec une amélioration du break-up time.
Dans les stades plus sévères, on observe un amincissement épithélial global plus marqué et diffus (figure 7) [8, 9]. En effet, en poursuivant notre raisonnement, il a été démontré que la prolifération anormale de cellules de l’épithélium conjonctival et cornéen est corrélée avec une production anormale de protéines pouvant induire une apoptose. L’apoptose excessive ou la destruction mécanique de l’épithélium cornéen, si elles ne sont pas compensées par un renouvellement rapide, peuvent conduire à un amincissement global de l’épithélium cornéen dans les cas de sécheresse oculaire sévère.
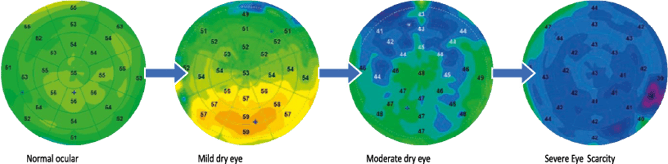 Figure 7. Proposition de classification de la sécheresse oculaire à partir des cartographies épithéliales.
Figure 7. Proposition de classification de la sécheresse oculaire à partir des cartographies épithéliales.
N.A. Edorh et al. [10] ont montré une corrélation statistiquement significative des cartes épithéliales avec le break-up time et le test de Schirmer et ont démontré comparativement à un groupe témoin que l’amincissement de l’épithélium cornéen, notamment en supérieur de l’apex, est un facteur de détection de la sécheresse oculaire avec une valeur seuil de l’épithélium cornéen de 50 µm. L’hyperplasie n’a pas été mise en évidence dans cette étude à cause d’un probable biais de recrutement des patients issus d’une consultation spécialisée de sécheresse oculaire et présentant des stades de sécheresse oculaire plus avancés.
La cartographie épithéliale devient un outil intéressant, parallèlement à l’examen clinique, pour objectiver et quantifier la qualité de la surface oculaire tant dans le bilan initial que dans le suivi des troubles chroniques de la surface oculaire [11].
Meibographie et évaluation du volume lacrymal
La meibographie est devenue une analyse incontournable pour évaluer le dysfonctionnement meibomien et sa sévérité. Désormais, certains appareils d’OCT disposent d’un module pour réaliser ces clichés à partir d’une caméra infrarouge (figure 8). Il est possible également d’obtenir des clichés meibographiques sur chaque machine OCT en détournant l’usage de la caméra infrarouge comme dans ce cas précis avec le Mirante™ (Nidek, Japon) (figure 9).
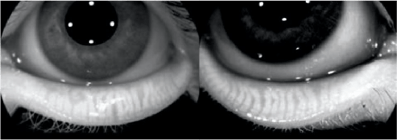
Figure 8 (L). Meibographie embarquée dans la plateforme OCT Solix™ mettant en évidence un dysfonctionnement meibomien de stade I-II
Figure 9 (R). Meibographie réalisée en utilisant de manière détournée la caméra confocale du rétinographe Mirante™..
L’OCT en coupe permet également de réaliser une imagerie du ménisque lacrymal inférieur avec la mesure de sa hauteur et de sa surface, matérialisant ainsi la sécrétion basale (figure 10). On peut également objectiver l’étendue des plis de conjonctivochalasis inférieur dont la sévérité est corrélée au risque de sécheresse oculaire (figure 11).
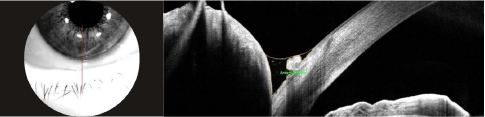 Figure 10. . Imagerie OCT B-scan verticale (Solix™) du ménisque lacrymal inférieur permettant de quantifier la hauteur et la surface de la -sécrétion basale.
Figure 10. . Imagerie OCT B-scan verticale (Solix™) du ménisque lacrymal inférieur permettant de quantifier la hauteur et la surface de la -sécrétion basale.
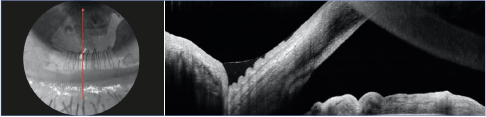
Figure 11. Imagerie OCT B-scan du ménisque de larmes inférieur mettant en évidence les plis de conjonctivochalasis.
OCT En Face de la cornée et sécheresse oculaire
L’OCT en face est une projection structurelle composée de nombreux B-scans dont l’espacement va varier en fonction de la densité des points de mesure, ce qui confère une certaine résolution à l’analyse cubique de cette acquisition. Cet examen a déjà démontré son intérêt dans les pathologies de la rétine, mais au niveau du segment antérieur son usage était limité en raison de la faible densité des B-scans.
L’augmentation récente de la vitesse d’acquisition avec les nouveaux appareils d’OCT spectral domain autorise une densité de 256 B-scans, offrant une belle projection de la cornée et de ses annexes.
L’OCT En Face nous permet de mettre en évidence l’instabilité de la couche lipidique du film lacrymal par des nuances de réflectivité du film lacrymal (figure 12). Certaines pathologies cornéennes associées à des troubles de la surface oculaire peuvent être observées en OCT en face, telles que la dystrophie de Cogan avec ses plis pathognomoniques de la membrane basale (figure 13) ou les kératites à adénovirus (figure 14), avec un suivi qui peut se faire conjointement avec le mapping épithélial.
Cette projection constitue une visualisation complémentaire dans une approche multimodale de la sécheresse oculaire par OCT.
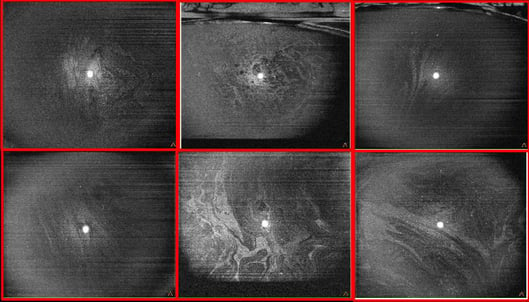 Figure 12. OCT En Face du film lacrymal (cube 8 × 8 mm, Solix™) avec visualisation de la couche lipidique et de son instabilité à travers différents cas cliniques.
Figure 12. OCT En Face du film lacrymal (cube 8 × 8 mm, Solix™) avec visualisation de la couche lipidique et de son instabilité à travers différents cas cliniques.SD-OCT: 120 000 A-scan/sec.
Axial Resolution: 5μm
OCT EN FACE: 256 Bcans
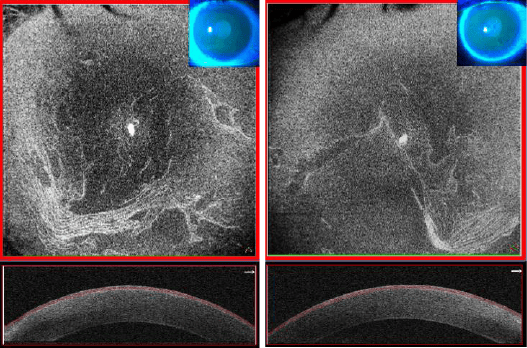 Figure 13. OCT En Face de la cornée (cube 8 × 8 mm, Solix™) dans un contexte de dystrophie de Cogan avec ses plis de la membrane basale de l’épithélium cornéen d’aspect plus prononcé sur l’œil droit.
Figure 13. OCT En Face de la cornée (cube 8 × 8 mm, Solix™) dans un contexte de dystrophie de Cogan avec ses plis de la membrane basale de l’épithélium cornéen d’aspect plus prononcé sur l’œil droit.
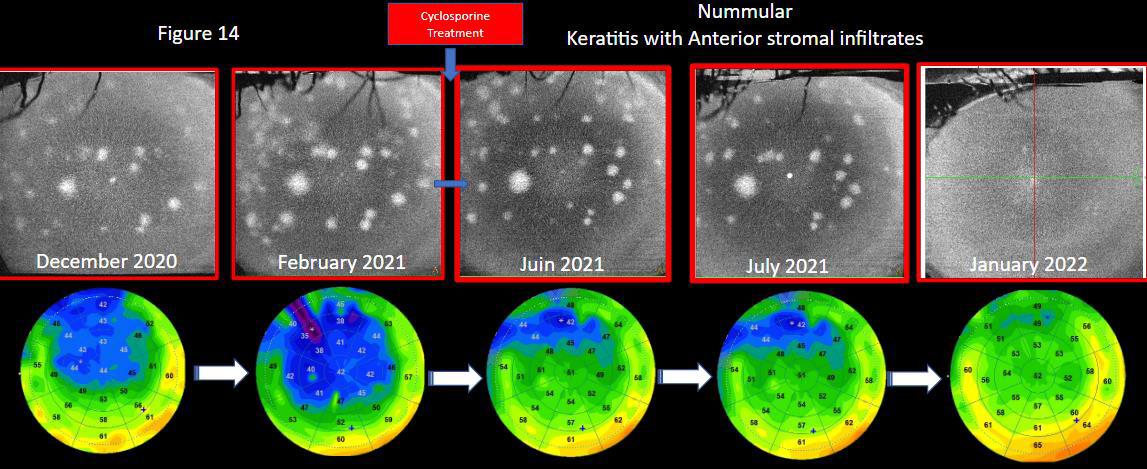 Figure 14. Suivi d’un patient présentant une kératite à adénovirus avec ses aspects d’opacités nummulaires au niveau du stroma antérieur et bien quantifiés par l’OCT en face (cube 8 × 8 mm, Solix™). Le mapping épithélial souligne par cet amincissement de l’épithélium les troubles de la surface oculaire associés. Après la mise en place d’un traitement par ciclosporine, la multimodalité en OCT met en évidence l’amélioration de la surface par un ré-épaississement de l’épithélium et une diminution progressive des opacités.
Figure 14. Suivi d’un patient présentant une kératite à adénovirus avec ses aspects d’opacités nummulaires au niveau du stroma antérieur et bien quantifiés par l’OCT en face (cube 8 × 8 mm, Solix™). Le mapping épithélial souligne par cet amincissement de l’épithélium les troubles de la surface oculaire associés. Après la mise en place d’un traitement par ciclosporine, la multimodalité en OCT met en évidence l’amélioration de la surface par un ré-épaississement de l’épithélium et une diminution progressive des opacités.
Perspectives diagnostiques cliniques
Les modifications de l’épithélium au cours du bilan initial et du suivi de la sécheresse oculaire vont offrir des données quantitatives non dépendantes de l’opérateur, permettant d’apprécier certains changements ressentis par le patient, mais pas toujours bien matérialisés par l’examen du break-up time dépendant de l’opérateur, mais également du volume de fluorescéine instillée.
La multimodalité disponible sur les plateformes OCT, incluant la meibographie, la mesure du ménisque de larmes inférieur et l’analyse du profil épithélial cornéen, permettra de renseigner le bilan initial de la sécheresse oculaire parallèlement à l’examen clinique et de surveiller de manière objective l’évolution du patient au cours de son traitement (figure 15).
À la recherche d’une certaine précision biométrique dans la chirurgie dite “premium”, que ce soit pour les implants multifocaux, toriques ou dans la chirurgie cornéenne, la comparaison entre la topographie épithéliale et la topographie cornéenne est indispensable pour optimiser la mesure des valeurs kératométriques [12].
La corrélation entre la topographie cornéenne et l’épimapping met en évidence que les modifications épithéliales induisent des changements de la courbure cornéenne avec une atténuation de la kératométrie dans les zones où il existe une hyperplasie épithéliale (figure 16).
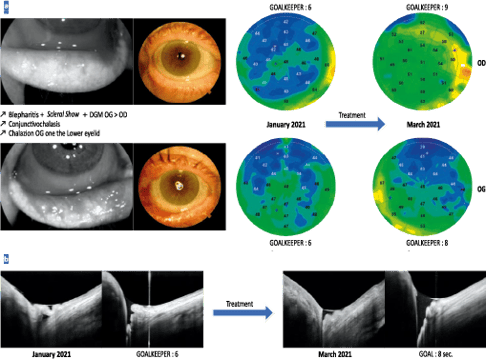
Figure 15. a. Suivi d’un patient, âgé de 66 ans, présentant un tableau de blépharite associant un scleral show avec de nombreux plis de conjonctivochalasis et un important dysfonctionnement meibomien d’aspect plus prononcé sur l’œil gauche. Après un traitement incluant un soin des paupières, un agent mouillant et une rééducation du clignement, on observe une amélioration du profil épithélial avec -ré-épaississement de l’épithélium cornéen et augmentation du break-up time.
b. L’analyse du ménisque lacrymal inférieur du patient montre, après traitement, une diminution des plis de conjonctivochalasis responsable d’un comblement du ménisque de larmes et -permettant la réapparition d’un certain volume basal.
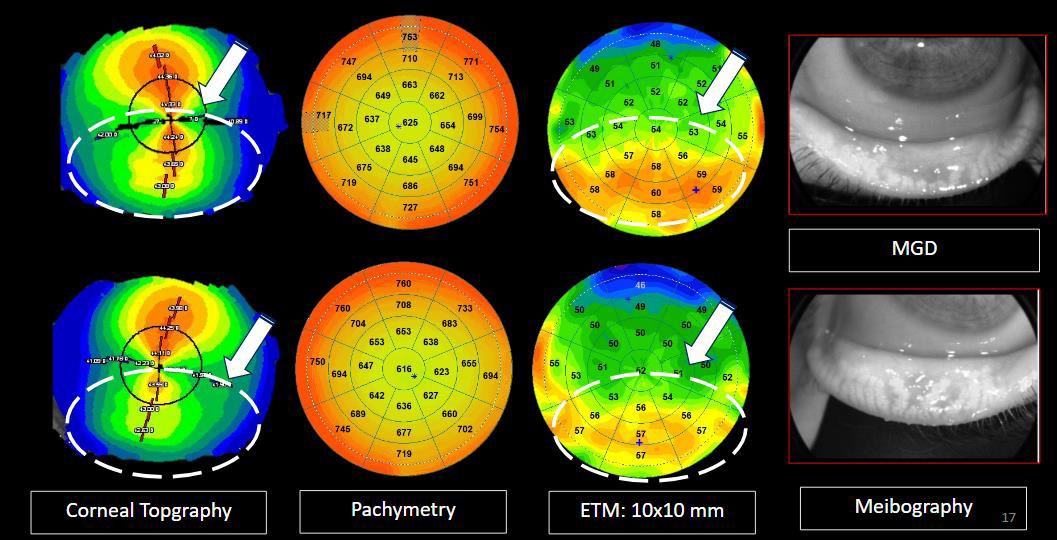
Figure 16. Jeune femme, âgée de 27 ans, avec des antécédents d’allergie aux acariens, candidate à une chirurgie réfractive et qui présente une topographie cornéenne irrégulière suspecte. La corrélation avec le mapping épithélial met en évidence une hyperplasie de -l’épithélium bilatérale en inférieur de l’apex associée à un dysfonctionnement des glandes de Meibomius modifiant la courbure cornéenne inférieure. Notez une hyperplasie plus prononcée de l’œil droit où l’atrophie des glandes de Meibomius est plus importante.
Conclusion
La topographie de l’épithélium cornéen semble un outil très intéressant pour obtenir une projection de la qualité de la surface oculaire objective en raison des modifications des cellules épithéliales cornéennes au cours de la sécheresse oculaire. L’OCT devient une plateforme multimodale pour l’analyse de la sécheresse oculaire avec la meibographie, la mesure du ménisque de larmes, l’OCT en face de la cornée et le mapping épithélial.
Cette nouvelle approche et cette quantification deviendront très probablement à l’avenir un standard pour l’analyse de la sécheresse oculaire que ce soit dans le dépistage ou dans le suivi ou dans le bilan initial en chirurgie réfractive.
A. El Maftouhi déclare avoir des liens d’intérêts avec Visionix (consultant).C. Baudoin déclare ne pas avoir de liens d’intérêts en relation avec cet article.
Références bibliographiques
- Reinstein DZ et al. Epithelial thickness in normal cornea: three-dimensional display with Artemis very high frequency digital ultrasound. J Refract Surg 2008;24:571-81.
- Li Y et al. Corneal epithelial thickness mapping by Fourier-domain optical coherence tomography in normal and keratoconic eyes. Ophthalmology 2012;119:2425-33.
- Kanellopoulos AJ, Asimellis G. In vivo 3-dimensional corneal epithelial thickness mapping as an indicator of dry eye: preliminary clinical assessment. Am J Ophthalmol 2014;157:63-68.e2e.
- Cui X Hong J et al. Assessment of corneal epithelial thickness in dry eye patients. Optom Vis Sci 2014;91:1446-54.
- Fabiani C et al. Corneal epithelial proliferation and thickness in a mouse model of dry eye. Exp Eye Res 2009;89:166-71.
- Baudouin C et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease: proceedings of the OCEAN group meeting. Ocul Surf 2013;11:246-58.
- Baudouin C et al. Revisiting the vicious circle of dry eye disease: a focus on the pathophysiology of meibomian gland dysfunction. Br J Ophthalmol 2016;100:300-6.
- El Maftouhi A, Baudouin C. OCT et sécheresse oculaire. Les Cahiers d’Ophtalmologie 2019;225:32-7.
- King-Smith PE et al. The thickness of the tear film. Curr Eye Res 2004;29:357-68.
- Edorh NA et al. New model to better diagnose dry eye disease integrating OCT corneal epithelial mapping. Br J Ophthalmol 2022;106(11):1488-95.
- El Maftouhi A, Denoyer A. OCT : l’intelligence de l’épithélium cornéen. Les Cahiers d’ophtalmologie 2022;252:28-32.
- El Maftouhi A, Denoyer A. Quelle est la place de l’OCT dans le bilan de chirurgie réfractive ? Réflexions ophtalmogiques 2020;231:28-32.


Adil El Maftouhi est un orthoptiste spécialisé dans l’imagerie et l’exploration oculaire au sein du CHNO des XV-XX (Paris) et au Centre Ophtalmologique de Rive Geneva, en Suisse. Il est l’auteur d’ouvrages internationaux sur l’OCT et l’OCT-A. Il a également publié plusieurs articles évalués par les pairs comme « OCT et sécheresse oculaire » et « OCT : l’intelligence de l’épithélium ».
Adil El Maftouhi travaille au développement et à l’exploitation des divers systèmes d’imagerie disponible en ophtalmologie pour exploiter le potentiel de chaque système au profit de la clinique. Il contribue en parallèle au développement de nouvelles applications et logiciels d’imagerie notamment sur la technologie de l’OCT. M. El Maftouhi participe également à des projets de recherche clinique et pharmacologique dans le domaine de la rétine médicale, du glaucome et de la malvoyance.
